![\includegraphics[width=50mm]{figures/SimpleCycle2.eps}](img372.png)
|
サイクルの中でも熱機関やヒートポンプとしては動作せず、何も起こらないサイクルもあり得る。 図B.3のような簡単なサイクルをまず考えよう。ピストンを押し、まわりに熱を伝える(状態1から状態2)。その後、元の状態までピストンを引き、まわりから熱を奪う(状態2から状態1)。
この時の圧力と温度の変化を考えよう。押すときに内部の圧力が上昇し(1→2)、引くときに内部の圧力が減少する(2→3)(図B.4)。まわりに熱が伝わり温度が下がることにより体積が減少し圧縮され(1→2)、まわりから熱を受け取り温度が上がることにより体積が増加し膨張する(2→1)(図B.5)。
この時の仕事と伝わった熱量について考える。ピストンに入るエネルギーを正とし、出るエネルギーを負とすると、状態1から状態2に変化した時の内部エネルギーの変化量
![]() [J]とまわりとやりとりした熱量
[J]とまわりとやりとりした熱量![]() [J]、仕事
[J]、仕事![]() [J]の関係は式(1.7)より以下のようになる。
[J]の関係は式(1.7)より以下のようになる。
同様に式(1.7)より状態2から状態1に変化したときは
再度状態1に戻って来た時、内部エネルギーは初めの1の値と等しくなるので、状態1から状態2への変化量と状態2から状態1への変化量の和はゼロとなる。
よって、熱量と仕事の関係は
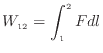
また同様に状態2から状態1での仕事
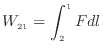
となる。状態1から状態2での力の変化と状態2から状態1での力の変化が同じように変化するとすれば、
式(B.3)と式(B.4)から、状態1から状態2での熱![]() [J]と状態2から状態1での熱
[J]と状態2から状態1での熱![]() [J]との和がゼロとなり、仕事も同様に和がゼロとなるので、サイクルとして動作した際(状態1→状態2→状態1)に、熱を仕事に変換していないことが分かる。また、図B.5から熱が高温から低温へ伝わっていることも分かる。よって、このサイクルは熱機関としてもヒートポンプとしても作用していない。2つの熱源との熱のやりとりをする過程において、系の温度が同じように変化しているため、仕事を取り出すことができない。熱のやりとりをする過程の間に、熱機関やヒートポンプサイクルのように、系の状態(温度)を変える過程を入れることにより、熱機関やヒートポンプとして動作することができる。
[J]との和がゼロとなり、仕事も同様に和がゼロとなるので、サイクルとして動作した際(状態1→状態2→状態1)に、熱を仕事に変換していないことが分かる。また、図B.5から熱が高温から低温へ伝わっていることも分かる。よって、このサイクルは熱機関としてもヒートポンプとしても作用していない。2つの熱源との熱のやりとりをする過程において、系の温度が同じように変化しているため、仕事を取り出すことができない。熱のやりとりをする過程の間に、熱機関やヒートポンプサイクルのように、系の状態(温度)を変える過程を入れることにより、熱機関やヒートポンプとして動作することができる。