C.2 理想気体温度と熱力学的絶対温度
理想気体温度と熱力学的絶対温度について、双方において可逆サイクルにおける熱の比と理想気体温度の比が等しくなることを示す。
理想気体の状態方程式は次のように表される。
| (C.1) |
ここで、アボガドロ数、ボルツマン定数。ボルツマン定数とアボガドロ数の積は気体定数となる。
| (C.2) |
可逆サイクルである理想気体で構成されるカルノーサイクルを考え、温度と熱源とやりとりする熱との関係を示す。
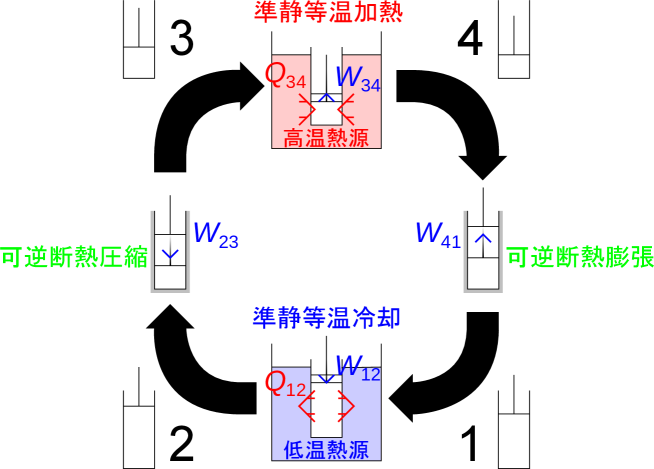
Figure C.4: 可逆サイクル(カルノーサイクル)
C.2.1 準静等温過程での関係
準静等温過程での関係を示すことで、熱源とのやりとりがわかる。カルノーサイクルは準静等温過程と可逆断熱過程の組み合わせであり、熱源との熱のやりとりは準静等温過程でのみ行われる。
高温側の準静等温膨張過程(3→4)と低温側の準静等温圧縮過程(1→2)でのエネルギーの保存式はそれぞれ次のように表される。
理想気体の内部エネルギーは温度のみの関数であるので、等温過程では変化しない。よって上式はそれぞれ次のように表される。
| (C.3) | ||||
上式で示されるように、仕事を求めれば熱源と交換される熱の大きさが分かるため、準静等温過程における仕事を求める。
上式と式(C.3)より次の式が求められる。
| (C.4) |
同様に低温側の準静等温圧縮過程(1→2)についても計算すると次式を得る。
| (C.5) |
C.2.2 可逆断熱過程での関係
可逆断熱過程での関係を求める。 まず、理想気体の内部エネルギーの変化が等積比熱により求められることを示す。
内部エネルギーを温度と体積の関数としてとして表すと、他変数関数の微分の定義より次式が得られる。
| 理想気体では内部エネルギーは温度のみの関数であるので | ||||
| 定積熱容量の定義から | ||||
| (C.6) | ||||
次に断熱過程においてサイクルの内部エネルギーは仕事によってのみ変化するため、次式が成り立つ。
| 式(C.6)より | ||||
| 理想気体の状態方程式より | ||||
| は定数 | ||||
| と置き直す | ||||
上式の右辺のは定数であるので、左辺のは常に同じ値をとることが分かった。
この図を含む文章の著作権は椿耕太郎にあり、クリエイティブ・コモンズ 表示 - 非営利 - 改変禁止 4.0 国際 ライセンスの下に公開する。最新版およびpdf版はhttps://camelllia.netで公開している。htmlファイルは LaTeXML を用いて作成した。
を用いて作成した。