| (1.18) |
![[*]](crossref.png) )であるので、可逆サイクルの効率を決める条件は二つの熱源の温度のみである。温度
)であるので、可逆サイクルの効率を決める条件は二つの熱源の温度のみである。温度
この関数
![]() がどのような関数か明らかにするため、図1.20に示すように、温度
がどのような関数か明らかにするため、図1.20に示すように、温度![]() [℃]の熱源と温度
[℃]の熱源と温度![]() の熱源で動作する可逆サイクル1と温度
の熱源で動作する可逆サイクル1と温度![]() [℃]の熱源と温度
[℃]の熱源と温度![]() [℃]の熱源で動作する可逆サイクル2、温度
[℃]の熱源で動作する可逆サイクル2、温度![]() [℃]の熱源と温度
[℃]の熱源と温度![]() [℃]の熱源で動作する可逆サイクル3を考える。このとき熱源の温度の関係は
[℃]の熱源で動作する可逆サイクル3を考える。このとき熱源の温度の関係は
![]() とする。
とする。
この場合の各サイクルの効率はサイクルの効率の式(1.12) (p. ![[*]](crossref.png) )と式(1.18)から熱源の温度により次のように表される。
)と式(1.18)から熱源の温度により次のように表される。
![[*]](crossref.png) )より
)より
が成り立つ。上3式を左辺の高温側熱源から伝わる熱量で割り、それぞれの効率(式(1.19)-式(1.21))を代入し変形すると以下の関係が成り立つ。
式(1.22)-式(1.24)へ式(1.25)を適用すると、それぞれのサイクルでの高温熱源からの熱と低温熱源からの熱の大きさの比は次のように温度の関数で表される。
サイクル2の低温側の熱源へ伝わる熱の大きさ![]() [J]と、サイクル3の高温側の熱源から伝わる熱の大きさ
[J]と、サイクル3の高温側の熱源から伝わる熱の大きさ
![]() [J]を、同じ大きさになるよう
1.18にそれぞれのサイクルを動作させて(
[J]を、同じ大きさになるよう
1.18にそれぞれのサイクルを動作させて(
![]() )、サイクル2とサイクル3を一つのサイクルとして動作させる。サイクル2とサイクル3の熱量の比の積から、次式の関係が成り立つ。
)、サイクル2とサイクル3を一つのサイクルとして動作させる。サイクル2とサイクル3の熱量の比の積から、次式の関係が成り立つ。
サイクル2とサイクル3を合わせた一つのサイクルとして考えると、温度![]() [℃]の熱源と温度
[℃]の熱源と温度![]() [℃]の同じ二つの熱源の間で動作する可逆サイクルとみなせるので、サイクル1と効率は等しくなる。効率が等しいので伝わる熱の大きさの比はサイクル1と等しく次式が成り立つ。
[℃]の同じ二つの熱源の間で動作する可逆サイクルとみなせるので、サイクル1と効率は等しくなる。効率が等しいので伝わる熱の大きさの比はサイクル1と等しく次式が成り立つ。
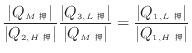
上式の最左辺と最右辺に式(1.26)、式(1.27)、式(1.28)を代入し温度の関数![]() で表すと、
で表すと、
となる1.19。ここで、左辺は
上式のように関数
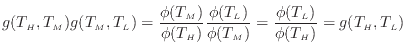
熱源の温度と、熱源とやりとりする熱量の関係をまとめると式(1.25)と式(1.5.3)より
ここで![]() は単一の温度の関数である。上式(1.31)の関係から温度を定義する[3]1.20。次の式の関係が成り立つように、温度の関数
は単一の温度の関数である。上式(1.31)の関係から温度を定義する[3]1.20。次の式の関係が成り立つように、温度の関数![]() をそのまま定義した温度
をそのまま定義した温度![]() を熱力学的温度(絶対温度)といい単位は[K](ケルビン)で表される。
を熱力学的温度(絶対温度)といい単位は[K](ケルビン)で表される。
また日常使われる摂氏温度
上二式から絶対温度
この熱力学的温度で表現すると、温度
![]() [K]と温度
[K]と温度
![]() [K]の二つの熱源で動作する可逆サイクルの熱源とやりとりする熱量
[K]の二つの熱源で動作する可逆サイクルの熱源とやりとりする熱量![]() [J]と熱量
[J]と熱量![]() [J]の関係は次のように熱力学的温度(絶対温度)の比で表される。
[J]の関係は次のように熱力学的温度(絶対温度)の比で表される。
![[*]](crossref.png) と式(1.25) p.
と式(1.25) p. ![[*]](crossref.png) 、式(1.32)より、温度
、式(1.32)より、温度